Visión general de la anatomía ocular.
SIGNOS Y SÍNTOMAS CLÍNICOS
El glaucoma es uno de los trastornos más frecuentes a nivel del segmento anterior del ojo. Los signos clínicos que evidencia dependen tanto del tipo de glaucoma como de la fase en que se encuentre dicho trastorno, variando a su vez en las distintas especies animales (Équidos, Cánidos, Félidos).
Por todo ello, se van a tratar los signos característicos que se manifiestan en cada una de las situaciones para realizar al final un cuadro sinóptico con los que comparten todos ellos.
(a) Según el modo de presentación:
a.1.- Glaucoma agudo (primario)
Hay un aumento en la Presión Intraocular (PIO), que produce signos evidentes en el perro y en el caballo, no así en el gato.
Por norma general, este trastorno origina una alteración en la transparencia de la córnea, dando lugar un Edema Corneal. Si este síntoma no se soluciona, debido a que no desciende la PIO, aparece otro problema añadido, Dolor Intenso. El ojo está aumentado de tamaño, buftálmico (especialmente en los Équidos). También hay otros signos evidentes, como el excesivo lagrimeo blefarospasmo, fotofobia, intensa hiperemia en vasos episclerales (ojo rojo) y pupila dilatada (midriática).
Esto siempre ocurre en el caso de perros y caballos, aunque en éstos es característica la aparición de franjas opacas corneales profundas, donde el espesor de la membrana de Descemet está disminuido, y, en general, el dolor es menor, con una ligera Iridociclitis.
El comienzo de los signos en gatos es insidioso, ya que no se aprecian con facilidad el edema y la congestión episcleral. Los gatos suelen presentar glaucomas secundarios a una uveítis, neoplasias intraoculares,… que producen la formación de protuberancias. De producirse primario, suelen ser de ángulo abierto. También se presenta en ellos buftalmía, especialmente por luxación del cristalino. De todos modos, la buftalmía puede no evidenciarse debido a que los párpados pueden ocultar el aumento del tamaño del ojo.
En vacuno se asocian a anomalías iridocorneales y a uveítis anterior.
a.2.- Glaucoma crónico (primario)
Se debe al desarrollo del glaucoma desde su fase aguda, y conlleva lesiones irreversibles en el nervio óptico. La primera diferencia con el agudo es que no se aprecia tanto dolor. En general, los signos clínicos son menos visibles en perros y gatos.
- En perros son secundarios a luxaciones del cristalino, así como a la propia buftalmía. Se pueden llegar a formar membranas fibropupilares preiridales y sinequias (ya que se obstruye el ángulo de filtración con células inflamatorias, fibrina y restos celulares), empeorando más aún el drenaje del humor acuoso, aumentando con ello la PIO. Además, también pueden ser secundarios a uveítis, neoplasias,…
- En gatos, al igual que el glaucoma agudo, puede formarse glaucoma crónico por cronicidad de una uveítis anterior. También por obstrucción de la filtración del humor con células inflamatorias,… Se aprecia buftalmía, queratitis y luxación del cristalino. También lagoftalmos,…
- En Équidos no se suele presentar, aunque, en caso positivo, se apreciaría buftalmía, dolor crónico y evolución a la ceguera.
a.3.- Congénito
Se podría hacer otro apartado con los glaucomas congénitos. En general se apreciaría buftalmía muy manifiesta, edema corneal, blefarospasmo, afectación de la membrana de Descemet,… y alteraciones en al trama trabecular, el limbo esclerocorneal,… Afectan a animales jóvenes, por mal desarrollo de las vías del humor acuoso.
a.4.- Secundario
Suelen derivarse de una causa genética, tras afectación del cristalino en unas cataratas o por luxación o subluxación del mismo. Hay obstrucción de la salida de humor acuoso. Son uni y bilaterales.
(b) Según la evolución del glaucoma:
b.1.- Inicial/Temprana
Aunque puede no presentar síntomas, pueden aparecer periodos transitorios de midriasis y edema corneal. También se observa hiperemia en los vasos episclerales. La PIO está entre 20 y 30 mmHg.
b.2.- Ligera/Moderada (Intermedia)
Se caracteriza por presentar midriasis, congestión de los vasos episclerales y edema corneal, pero se empieza a apreciar buftalmía y luxación de cristalino en fase inicial. La PIO es de 30-40 mmHg. La visión es algo menor.
b.3.- Avanzada
Importante midriasis, edema corneal, buftalmía, sinequias y adherencias en la córnea. Hay degeneración de la retina y del disco óptico, y más alteraciones de carácter grave. La PIO está entre 40-50 mmHg. La visión está muy disminuida llegando incluso hasta la ceguera.
* También podemos analizar los síntomas según las razas de perros, gatos o caballos, pero no diferirían en lo más característico. Desde un punto de vista clínico, se puede hacer una sinopsis con los signos más visibles, sin atender al tipo de animal, evolución o presentación. Son:
- Elevación por encima de 25-30 mmHg de la PIO.
- Dolor y aumento de coloración rojiza del globo ocular (congestión de los vasos episclerales).
- Edema corneal.
- Pupilas dilatadas (midriáticas).
- Buftalmía.
- Lagoftalmos.
- Queratitis.
- Luxación del cristalino.
- Atrofia del disco óptico y retina.
- Formación de sinequias.
- Almacenamiento de células inflamatorias y fibrina en el ángulo de filtración.
- Blefarospasmo.
- Fotofobia.
- Lagrimeo intenso.
- Alteración a nivel de la membrana de Descemet.
- Ceguera
- Apatía, decaimiento, depresión,…
Concretando, y de un modo resumido según el tipo de glaucoma:
A) Glaucoma primario (crónico) [Ángulo abierto]:
- Frecuente en perro, raro en gatos.
- Anisocoria.
- Edema corneal difuso.
- Leve inyección episcleral.
- Aumento de tamaño del globo ocular.
- PIO 30-40 mmHg.
- Luxación cristaliniana.
- Pérdida irreversible visión.
- ¿Y el nervio óptico, cómo está?
B) Glaucoma primario (agudo):
- Dolor.
- Color azul corneal (hay edema).
- Midriasis.
- Inyección ciliar.
- Pérdida de visión.
- Buftalmos (en caso de que persista).
C) Glaucoma secundario:
- Anomalías del cristalino.
- Tras cirugía de catarata.
- Anomalías en la úvea.
- Medicaciones.
- Goniodisgenesias.
DIAGNÓSTICO
El glaucoma es fácilmente diagnosticable, ya que sus signos clínicos son bastante evidentes. Lo difícil es averiguar la causa originadora del problema.Se suele centrar en la percepción del aumento en la PIO, así tenemos un método diagnóstico como la Tonometría. También nos podemos basar en el ángulo iridocorneal, fundamento de la Gonioscopia. Aunque sean los dos procedimientos más fiables, también podemos usar otros complementarios, que nos ayudarán en otros aspectos relacionados, como:
- Oftalmoscopia (directa/indirecta).
- Retinoscopia.
- Tonografía.
- Ecografía ocular.
- Electrorretinografía.
- Angiografía fluoresceínica.
- Campimetría.
- Citología conjuntival.
- Biomicroscopía con lámpara de hendidura.
- Radiología.
- Queratoscopía.
A) Tonometría
Permite valorar la PIO. Existen varios tipos de Tonometría:
A.1.- Tonometría digital:
Se basa en la aplicación de presión en los ojos mediante los dedos de la mano. Se evalúa mediante un masaje en los párpados superiores, y en los dos ojos a la vez, para compararlos. No es un sistema muy perfecto, ya que no es objetivo y requiere mucha experiencia, así como la comparación con un globo ocular normal (sano).
A.2.- Tonometría por indentación (Schiotz):
Mide la indentación de la córnea producida por un Tonómetro de Schiotz. Éste está constituido por un émbolo que se desplaza por un cilindro hueco centrado en un vástago y tiene también una plataforma adaptable que se coloca sobre la superficie corneal, previamente anestesiada (localmente con proximetacaína). No debe tocar los párpados en su descenso ni el tercer párpado. Se hacen tres lecturas siempre, que difieran menos de 1-2 unidades entre sí.
Este sistema sugiere distintos problemas, como que el tamaño del globo ocular, la variación de la rigidez escleral respecto de la edad o las lesiones a nivel corneal afectan a los datos obtenidos.
Deben tenerse en cuenta unas
consideraciones para su uso óptimo:
- Hay que calibrarlo siempre al principio (“puesta a punto”).
- Debe estar completamente limpio, ya que, en caso contrario, daría lecturas no fiables.
- La anestesia local de la córnea debe realizarse con cuidado, evitando incrementar o reducir la PIO como consecuencia. Asimismo, cuidado al realizar la prueba, intentando no tocar el tercer párpado, el limbo o los párpados, en general.
- No realizar este procedimiento en caso de una intervención ocular muy reciente o de edema corneal que lo obstaculice.
- Realizar varias mediciones y siempre en los dos ojos.
A.3.- Tonometría por aplanamiento:
Mide la fuerza necesaria para aplanar una pequeña superficie de la córnea.
Se usa un Tonómetro (Tono-Pen), compuesto por una sonda de acero que posee dentro un calibrador electrónico. Al contactar éste con la córnea (mediante una membrana esterilizada) se produce una onda que indica la PIO que se quiere saber. Hay que realizar cuatro mediciones (a diferencia de las tres del Tonómetro de Schiotz). Requiere anestesia tópica también.
Las ventajas respecto a la anterior son:
- Mayor precisión.
- No hace falta inmovilizar tanto al animal.
- Mayor comodidad.
El mayor inconveniente es el elevado coste que tiene.
En ganado vacuno y en el caballo sólo se pueden usar este tipo de tonómetros.
B.- Gonioscopia:
Mide la alteración del índice de refracción corneal a medida que evoluciona el glaucoma. El ángulo iridocorneal, así como las vías de drenaje se observan mediante una lente refractiva que se coloca en la superficie de la córnea, permitiendo así que la luz reflejada pase desde la región del ligamento pectinado hasta el ojo del explorador veterinario. Requiere anestesia tópica. Las lentes más usadas son las de Barkan, Franklin Goldman o Koeppe. El mecanismo, aunque parezca complicado, es bastante sencillo.
A la interfase entre la lente gonioscópica y la córnea, aparte de haberle aplicado anestesia, también debe tener suero salino (o solución de metilcelulosa al 1% en otros casos). De este modo se forma una película con presión negativa, que ayuda a que la lente permanezca unida a la córnea.
Aparte de la lente y demás líquidos, también requiere el uso de lupa (aunque lo mejor es el biomicroscopio) y una fuente de luz (procedente del propio oftalmoscopio). Tenemos que observar antes de llevar este procedimiento a cabo si hay depósitos de fibrina, células inflamatorias,… y proceder a su limpieza para no interferir en la medida. También evaluar si hay alteraciones en el ligamento pectinado (o pectíneo) o infiltrados neoplásicos.
Mencionar también que el sistema de las lentes Goldman y Barkan, (las más usadas) es algo distinto, ya que, mientras en las primeras el ángulo iridocorneal se observa indirectamente a través de un espejo que lleva la lente, en los segundos se ve el ángulo directamente. El resultado más frecuente en perros es observar el ángulo de filtración estrecho o cerrado, así como displasia en el ligamento pectíneo.
- Otro método “casero” en el supuesto de que no tengamos posibilidad de adquirir este tipo de lentes se basa en el uso de lentes de condensación de 20-30 dp, que se colocan encima de la córnea y se presionan (con el ojo previamente anestesiado y tras lubricarlo). De este modo veremos cómo está el ángulo de drenaje.
C.- Técnicas Complementarias:
Aunque para el diagnóstico del glaucoma se recurre a los dos procedimientos antes tratados, también se pueden realizar otras pruebas que ayudan a su detección y confirman el diagnóstico, pero no están sistematizadas desde el punto de vista de la Oftalmología Veterinaria. Vamos a citar brevemente cuáles son las más utilizadas y su mecanismo básico.
C.1.- Oftalmoscopía:
Se emplea para explorar el fondo del ojo. El instrumento usado es el oftalmoscopio, habiendo suministrado midriáticos al animal y llevando a cabo la operación en oscuridad.
Mediante la oftalmoscopía directa se incide la luz a través de la pupila, que refleja y vuelve al ojo del explorador veterinario. De este modo, si la imagen no es nítida, se puede sospechar de alguna anomalía. Con ella se explora especialmente el segmento anterior del ojo.
Las diferencias con la indirecta es que, aparte de que la imagen que se ve es invertida (y con menos aumentos que la directa), es más compleja de realizar, con ésta se examina especialmente la cámara y el segmento posterior del ojo.
C.2.- Ecografía oftálmica:
Emite ondas de sonido de elevada frecuencia, que van desde la córnea hacia el fondo del ojo, y los ecos producidos se reciben y originan una imagen. Aparte de examinar el globo ocular, también se evalúan los tejidos blandos y óseos de la órbita. Puede detectar opacidades, desprendimientos de retina, tumores,…
Hay dos tipos de ecografía, la ecografía unidimensional en modo A (que mide parámetros biométricos, como el espesor corneal o el grosor del cristalino) y en modo B (que examina la existencia de lesiones en estructuras internas).
C.3.- Radiología:
No se usa mucho, aunque sí como antesala de una posterior RM, TAC o Ecografía. También se puede hacer junto con el uso de colorantes de contraste, para evaluar otras lesiones.
C.4.- Retinoscopía:
Evalúa el estado refractivo del ojo. Se basa en la iluminación de la retina emitida por un retinoscopio. De este modo se consigue ver la potencia refractiva del ojo. Mediante esta técnica de refracción se diferencian los problemas tan típicos como la miopía, la hipermetropía o el astigmatismo.
C.5.- T.C. de la córnea (Queratoscopia):
Explora la curvatura de la superficie corneal, proyectando sobre ella anillos concéntricos de luz (disco de Placido). Luego se mide la distancia entre los mismos y se ven las alteraciones. Antes de llevar a cabo la técnica de refracción (retinoscopia) se debe tener en cuenta la realización de esta prueba.
C.6.- Biomicroscopía de lámpara de hendidura:
Examina los distintos elementos del globo ocular, observando las lesiones que pudiera haber en los anejos, córnea, cámara anterior, etc.
Se compone de un diafragma con una hendidura que, de una imagen tridimensional, proyecta un chorro de luz sobre las estructuras. Dependiendo de si queremos observar el segmento anterior o posterior, las lentes son diferentes.
C.7.- Electrofisiología ocular:
Estudia los potenciales eléctricos debidos a la actividad de las células visuales, vías ópticas y córtex visual. Dentro de este apartado está el ERG (Electrorretinografía) y el PEV (Potenciales Evocados Visuales).
El primero registra la respuesta a un estímulo luminoso según la diferencia de potencial entre la retina y la córnea, cuando la retina es fotoestimulada.
El segundo registra potenciales eléctricos de la corteza visual tras ser estimulada también la retina. Mediante esta técnica se valoran los componentes de la retina y las vías visuales, diferenciando si el problema es a nivel periférico o central.
C.8.- Angiografía fluoresceínica:
Evalúa la existencia de problemas funcionales en la vascularización del ojo tras el paso de un colorante acuoso (fluoresceína) por los vasos corioides y retinianos. Resulta muy eficaz para detectar inflamaciones y el edema corneal.
Si la fluoresceína se observa de color verde tras su aplicación indica lesiones corneales y alteración de la permeabilidad de las vías lacrimales.
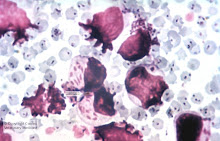
C9.- Citología conjuntival:
Mediante esta prueba se identifican células inflamatorias, epiteliales, fibrina y otros elementos (bacterias, inclusiones,…), básicas para esclarecer procesos inflamatorios o neoplásicos en el globo ocular, que agravan el proceso del glaucoma. Se realiza un raspado suave de la superficie (con más o menos profundidad) y se tiñe y fija con metanol.Suele ser recomendable anestesiar, pero nunca localmente, ya que puede afectar la anestesia a alguno de los elementos antes citados.